היסטים איזוטופיים ותופעות איזוטופיות נוספות
היסטים איזוטופיים הם שינוים קלים בהיסט כימי שנראים בין איזוטופמרים של מולקולה. הם משמשים כלי לחקר מבנה וקישור בנוסף לפענוח של ספקטרומים. ההחלפה השכיח ביותר לחקור היא בין פרוטון (1H) ודוטריום (2D) אומנם קיימת מגוון רב של אפשריות למחקר.
הגורמים שמשפיעים על גודל ההיסט האיזוטופי הם השינוי היחסי במשקל האטום (גדול ביותר עבור מימן), טווח היסט הכימי והמרחק דרך קשרים בין הגרעין הנצפה ובין הגרעין המוחלף.
יש שני סוגים של היסטים איזוטופיים:
- ראשוני – השינוי בהיסט כימי של אטום עם התמרת האיזוטופ לדוגמה ההיסט כימי של 1H לעומת ההיסט הכימי של 2D.
- משני – שינוי ההיסט כימי של אטום בהמרה איזוטופ של אחד האטומים השכנים. לדוגמה ההפרש בהיסט הכימי בפחמן בין CH3OH ו-CH3OD.
מינוח
היסט איזוטופי מוגדר כשינוי בשינוי ההיסט כימי כתוצאה מהתמרת גרעין כבד בגרעין קל של אותו יסוד. אם נציג זאת כמשוואה נקבל:
nΔX(H) = δX(L)-δX(H)
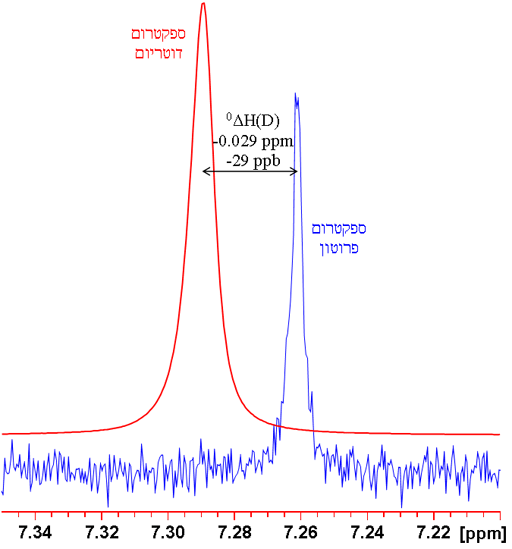
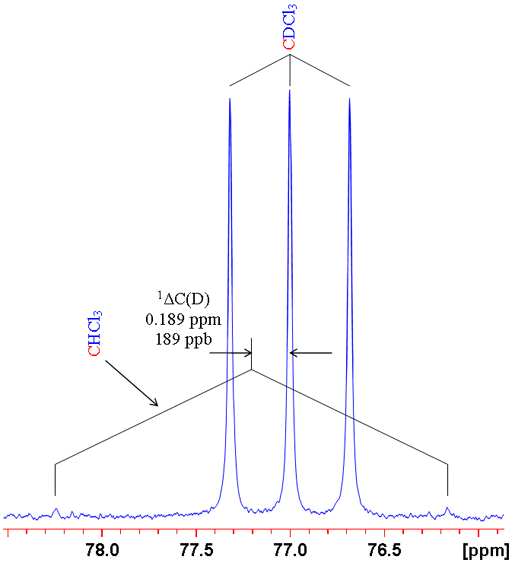
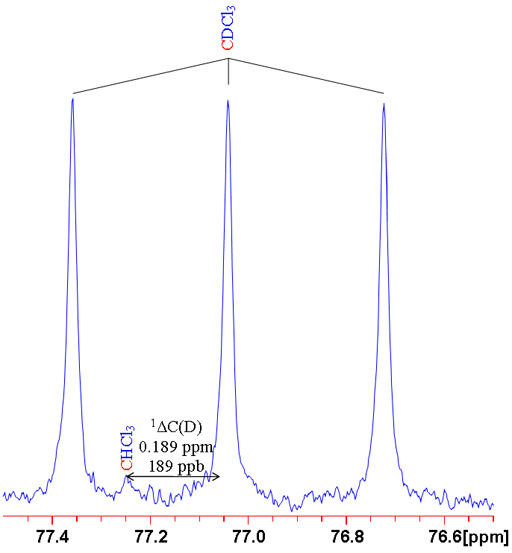
כאשר n הוא מספר הקשרים בין האיזוטופ המומר והאיזוטופ הנצפה (אפס להיסט איזוטופי ראשוני), X הוא הגרעין הנצפה L הוא האיזוטופ המותמר הקל, H הוא האיזוטופ המותמר הכבד ו-δהוא ההיסט הכימי. לדוגמה ההיסט כימי של מימן הנצפה ב- CHCl3 בהתמרה של פרוטן לדוטריום (CDCl3) ניתן כ-0ΔH(D) = -0.029 חל"מ (תרשים 1). יש נוהגים להביע אותם בחלקים למיליארד (ppb) משום שהם כה קטנים. לכן ניתן לכתוב -0.029 חל"מ כ--29 ppb.
תרשים 1. השוואה בין ספקטרומים 1H ו-2D של CDCl3 (עם שרידי CHCl3) שמראה היסט איזוטופי ראשוני
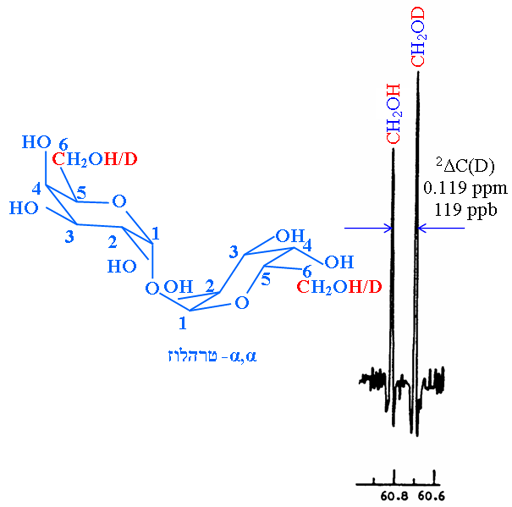
בדוגמה נוספת, ההיסט האיזוטופי על ספקטרום ה-13C (תרשים 2) כתוצאה מהתמרת OH ב-OD ניתן ב-2ΔC(D) = 0.119 חל"מ.
תרשים 2. ספקטרום 13C של C-6 של α,α-טרהלוז המראה היסט איזוטופי מישני
אם יש יותר מסוג אחד של איזוטופ קל, כותבים את ההיסט האיזוטופי כך:
nΔX(L, H) = δX(L)-δX(H)
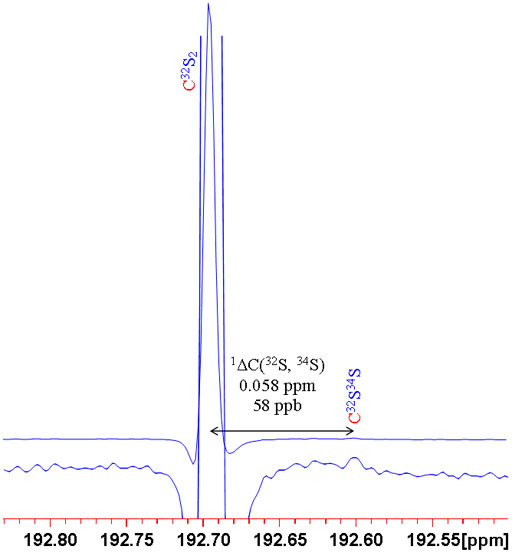
לדוגמה, לגופרית יש ארבע איזוטופים: 32S (השכיחות הטבעית 95.0%), 33S (0.76%), 34S (4.22%) ו-36S (0.02%). נגיד שאנחנו רוצים למדוד את ההיסט האיזוטופי כתוצאה מהמרת האיזוטופ של גופרית על אות ה-13C של CS2. אם נסתכל באיזוטופ השני בשכיחותו, 34S, ביחס לאיזוטופ קל יותר נצטרך להגדיר איזה איזוטופ. נתון ש-32S שכיח ביותר ו-33S קשה למדידה יותר כתוצאה מהרחבה ארבע-קוטבית, ברור ש-32S הוא הגרעין המועדף. בכל זאת חייבים להגדיר זאת כדי לצאת מאי-וודאות. לכן כותבים את ההיסט האיזוטופי כך: 1ΔC(32S, 34S) = 0.058 חל"מ (תרשים 3).
תרשים 3. ספקטרום 13C של CS2 המראה היסט איזוטופי משני כתוצאה מהמרה ב-34S
היסטים איזוטופיים ראשוניים
היסט איזוטופי ראשוני הוא השינוי בהיסט כימי הנצפה בין ספקטרומים של איזוטופים שונים של אותו יסוד, כמו פרוטון ודוטריום. בדרך כלל היסטים איזוטופיים ראשוניים בין 1H ו-2D קטנים מ-0.1 חל"מ. לעומת זאת, הם גדולים יותר במערכות עם קשרי מימן כאשר גודלם מעיד על חוזק קשר המימן. לפעמים היסטים ראשוניים של דוטריום עולים על חל"מ 1. היסטים איזוטופיים ראשוניים נחקרו עבור אטומים אחרים בעלי גרעינים שונים עם פעילות מגנטית כמו 10/11B, 35/37Cl, 50/51V, 117/119Sn, ו-123/125Te.
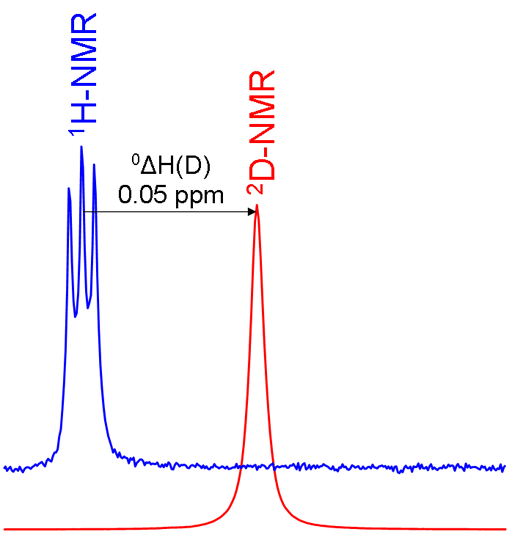
מודדים היסטים איזוטופיים ראשוניים באיסוף ספקטרומים של שני האיזוטופים ומכיילים לפי היחס התקנית בין התדרים (Ξ). אם המימן בודד כמו לדוגמה בכלורופורם הנזכר לעיל, ניתן למדוד את ההיסט האיזוטופית כמרחק בין הסינגלטים בספקטרומים. אולם אם יש יותר ממימן זהה אחד כמו במתילן כלוריד (CD2Cl2) ומחליפים רק מימן אחד, הספקטרום של CHDCl2 מראה צימוד פרוטון-דוטריום. במקרה זה סיגנל המימן מפוצל לשלושה על ידי גרעין הדוטריום בעל ספין אחד (תרשים 4).
תרשים 4. השוואה בין ספקטרומים 1H ו-2D של CD2Cl2 (עם שריות CHDCl2) שמראה היסט איזוטופי ראשוני וצימוד פרוטון-דוטריום בספקטרום 1H
היסטים איזוטופיים משניים
היסטים איזוטופיים משניים נחקרו בהרחבה. היסטים כימיים על פרוטונים קטנים בדרך כלל. היסטים איזוטופיים גדולים מסוג 1H/2D על פרוטונים שכינים מעידים בדרך כלל על קשר מימן אבל יכול לנבוע גם מהפרעה סטרית (מרחבית).
היסטים איזוטופיים גדולים יותר נראים באטומים אחרים, לדוגמה 13C. היסטים איזוטופיים חד-קשריים שנובעים מהמרת דוטריום נעים בין 0.2 ו-1.5 חל"מ. היסטים דו-קשריים אופייני ל-0.1 חל"מ. תופעות תלת-קשריות תלויות בזווית פיתול בנוסף לגורמים אחרים ויכולות להיות בין 0.02- ו-0.07 חל"מ. תופעות לטווח ארוך יותר בדרך כלל חלשות יותר מ-0.01 חל"מ אבל יכול להיות גדולות יותר כאשר מסלול הקישור מקוצר על ידי קישר מימן או קשר חלש אחר או אם קיימת הפרעה סטרית באתר התהמרה שגורמת לעיוות לאורך טווח במולקולה. בניגוד לכך התופעה החד קשרית של 12/13C על 1H בדרך כלל 0.002 חל"מ.
ניתן למדוד היסטים איזוטופיים משניים מתערובת של איזוטופומרים. ברוב המקרים זאת אומרת המרה חלקית במערכות עם חילוף איטי וללא חילוף בטמפרטורת החדר, לדוגמה OH ו-NH. הספקטרום הנוצר מכיל 'מולטיפלטים' כאשר כל קו שייך לאיזוטופומר שונה (תרשים 5). אין לבלבל את ה'מולטיפלטים' האלה במולטיפלטים הנובעים מצימוד ספין-ספין.
תרשים 5. ספקטרום 13C של α,α-טרהלוס מותמר חלקית בדוטריום המראה היסטים איזוטופיים משניים הנובעים מאיזוטופומרים שונים
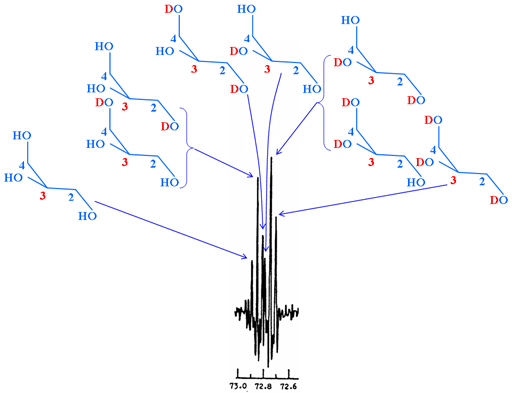
קיים חילוף מהיר, ניתן למדוד את סך כל ההיסטים האיזוטופיים מהשוואה בין הממס מתחלף הפורטר (בדרך כלל H2O) ובין הממס הדוטר (בדרך כלל D2O).
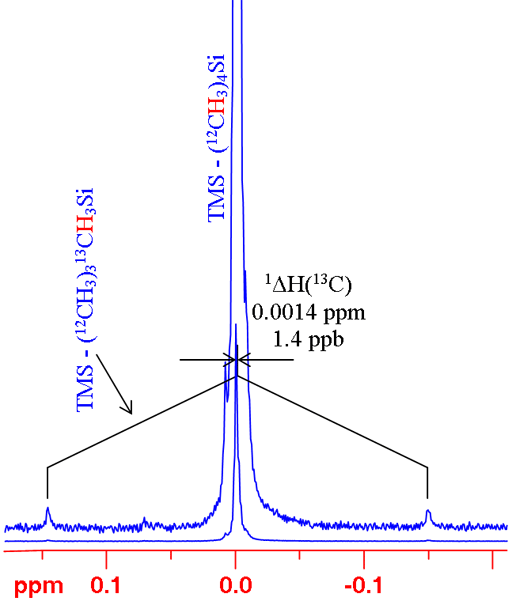
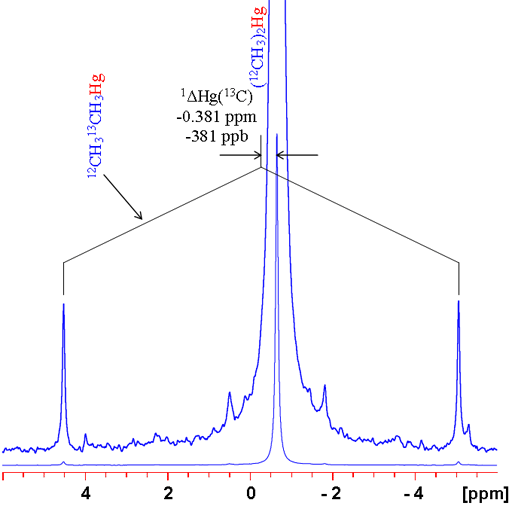
במקרים רבים, החלפת האיזוטופ משנה את צורת הצימוד. לדוגמה, אין ל-12C ספין ולכן אין צימוד ואילו ל-13C יש צימוד גדול עם 1H. עבור סינגלטים בודדים, ניתן להשוות בצורה פשוטה בין אמצע הדובלט והסינגלט (תרשים 6). מובאות כאן שתי דוגמאות: ספקטרום ה-1H של טטרמתילסילן (TMS) וספקטרום 199Hg של דימתיל כספית (תרשים 7). בשני המקרים, הסיגנל שנראה מבודד מצימוד הומוגרעיני שמאפשר מדידה פשוטה של ההיסט האיזוטופי. שים לב שההיסט האיזוטופי של כספית פי כ-300 מזה של פרוטון. כמו כן, טווח ההיסט הכימי של כספית פי כ-300 גדול יותר מזה של פרוטון.
תרשים 6. ספקטרום 1H של TMS המראה מדידה של היסט איזוטופי של 13C על 1H עבור פרוטון בודד
תרשים 7. ספקטרום 199Hg של דימתיל כספית המראה מדידת היסט איזוטופי של 13C. שם לב שההיסט גדול והלווינים נראים אסימטריים.
שני האיזיטופים עשויים לפצל והפיצולים עשויים להיות שונים. לדוגמה התמרת פרוטון הקשור ל-13C בדוטריום הפיצול הופך מדובלט (מאחר ש-1H בעל ספין ½) לטריפלט (מאחר ש-2D בעל ספין 1) (תרשים 8).
תרשיפ 8. ספקטרום 13C של CDCl3 (עם שריות של CHCl3) המראה דובלט עבור CHCl3 וטריפלט עבור CDCl3
בדרך כלל מפרים את הצימוד לפרוטן בספקטרומים של 13C לכן CHCl3 מופיע כסינגלט (תרשים 9).
תרשים 9. ספקטרום 13C של CDCl3 (עם שריות של CHCl3) עם הפרת צימוד לפרוטון המראה סינגלט עבור CHCl3 וטריפלט עבור CDCl3
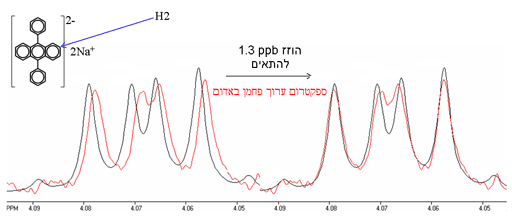
במקום שקיים צימוד הומוגרעיני, ותופעות צימוד מסדר שני בדרך כלל גדול יותר מההיסט האיזוטופי. למרות שבעקרון ניתן לחשב תופעות צימוד מסדר שני, החישוב מסורבל וקשה לבצע בדיוק הנדרש. לכן עדיף להשתמש בשיטות של עריכת הספקטרום ולהשוות בין ספקטרומים (תרשים 10). אולם יש להיזהר עד מאוד לוודא שהתנאים זהים בדיוק כולל ייצוב טמפרטורה והשוואת התחממות הדוגמה מתדר רדיו מאחר שהיסטים של 1H משתנים בכ-0.001 חל"מ/K.
תרשים 10. השוואה בין ספקטרום ה-1H של C2 של דונטרן דיפנילאנתרצן ובין הספקטום הערוך של האיזוטופומר המותמר ב-13C. ההיסט האיזוטופי נמדד מהתאמת שני הספקטרומטרים. שים לב שהספקטרום המסומן ב-13C קצת רחב יותר משום שיש מסלול רלקסציה נוסף דרך 13C.
תופעות איזוטופיות בצימוד ספין-ספין
תופעות איזוטפיות ראשוניות הם הרכבה של הבדלים בתכונות ספון הגרעין של הגרעין המומר והבדלים בתדר התהודה שלו. לדוגמה, גרעין צמוד לפרוטון בעל ספין ½ נותן דובלת ואילו אותו גרעין צמוד לדוטריום ספין 1 ייתן טריפלט.
גודל הצימוד תלוי באופן ישיר לתדר התהודה של הגרעין. לדוגמה לפחמן ארומטי יש צימוד של 160 הרץ ל-1H וצפוי שיהיה צימוד של 160 × 0.154 = 24.6 Hz ל-2D.
תופעות משניות על צימוד בדרך כלל שוליות. לדוגמה ההשפעה על צימוד דרך שני קשרים בין 1H ו-29Si ב-TMS הוא 6.64 הרץ כאשר יש 12C ביניהם ואילו הצימוד פוחט ב-1.5% ל-6.54 הרץ כאשר יש 13C ביניהם המעיד על הארכה קטנה מאוד של הקשרים.
מקורות
- P. E. Hansen "Isotope effects on nuclear shielding", Ann. Rep. NMR Spectrosc., 15, 105-234 (1983).
- P. E. Hansen "Isotope effects in nuclear shielding", Prog. NMR Spectrosc., 20, 207-255 (1988).
- D. B. Davies, J. C. Christofides, and R. E. Hoffman "Isotope Shifts in NMR Spectroscopy - Measurements and Applications", Isotopes: Essential Chemistry and Applications Ed. J. R. Jones, Royal Society of Chemistry (1988).